Dans un rapport de cas récemment publié dans la revue Maladies infectieuses émergentesLes chercheurs ont décrit une maladie neurologique causée par le paramyxovirus aviaire du pigeon de type 1 (PPMV-1) qui a entraîné la mort d’un enfant en bas âge immunodéprimé en Australie. Ils ont découvert que les tests métagénomiques sans hypothèse sont un outil utile pour diagnostiquer des étiologies indéfinies, comme dans ce cas.
 Recherche: Infection neurologique humaine mortelle causée par le Pigeon Avian Paramyxovirus-1, Australie. Source de l’image : THANAN KONGDOUNG / Shutterstock
Recherche: Infection neurologique humaine mortelle causée par le Pigeon Avian Paramyxovirus-1, Australie. Source de l’image : THANAN KONGDOUNG / Shutterstock
arrière-plan
Le paramyxovirus aviaire de type 1 (APMV-1) est un virus à ARN simple brin connu pour provoquer la maladie de Newcastle, une maladie infectieuse avec des manifestations neurologiques, digestives et respiratoires chez les oiseaux. Chez l’homme, cette maladie zoonotique se manifeste généralement par une conjonctivite légère et est rarement mortelle. Dans le cas présent, les chercheurs ont signalé une maladie neurologique provoquée par une variante pigeonnelle de l’APMV-1 (PPMV-1), transmise principalement par les pigeons, qui a entraîné la mort d’un patient pédiatrique immunodéprimé.
L’affaire
Une fillette de 2 ans ayant des antécédents de cellules pré-B leucémie lymphoïde aiguë (LAL), traité par blinatumomab il y a six mois, a présenté après trois semaines des symptômes des voies respiratoires supérieures avec nausées et vomissements. Elle avait subi la deuxième série de chimiothérapie de réinduction avec de la 6-mercaptopurine, de la cytarabine et du cyclophosphamide il y a six semaines. Il n’y avait aucun antécédent de maladie, d’animal domestique ou de voyage. Au fur et à mesure que son état progressait au cours des quatre jours suivants, elle a développé le syndrome d’épilepsie liée à une infection fébrile (FIRES).
La première image par résonance magnétique (IRM) du cerveau était normale. Les tests de recherche d’encéphalite auto-immune étaient négatifs. Une inflammation significative a été observée dans le système nerveux central (SNC), comme l’indique l’augmentation des taux de neurotropines (1 752 nmol/L) dans le liquide céphalo-rachidien. Les résultats du séquençage de l’exome n’ont révélé aucune anomalie génétique. Aucun agent pathogène bactérien, fongique, viral ou mycobactérien n’a été trouvé lors des tests de culture et de réaction en chaîne par polymérase (PCR).
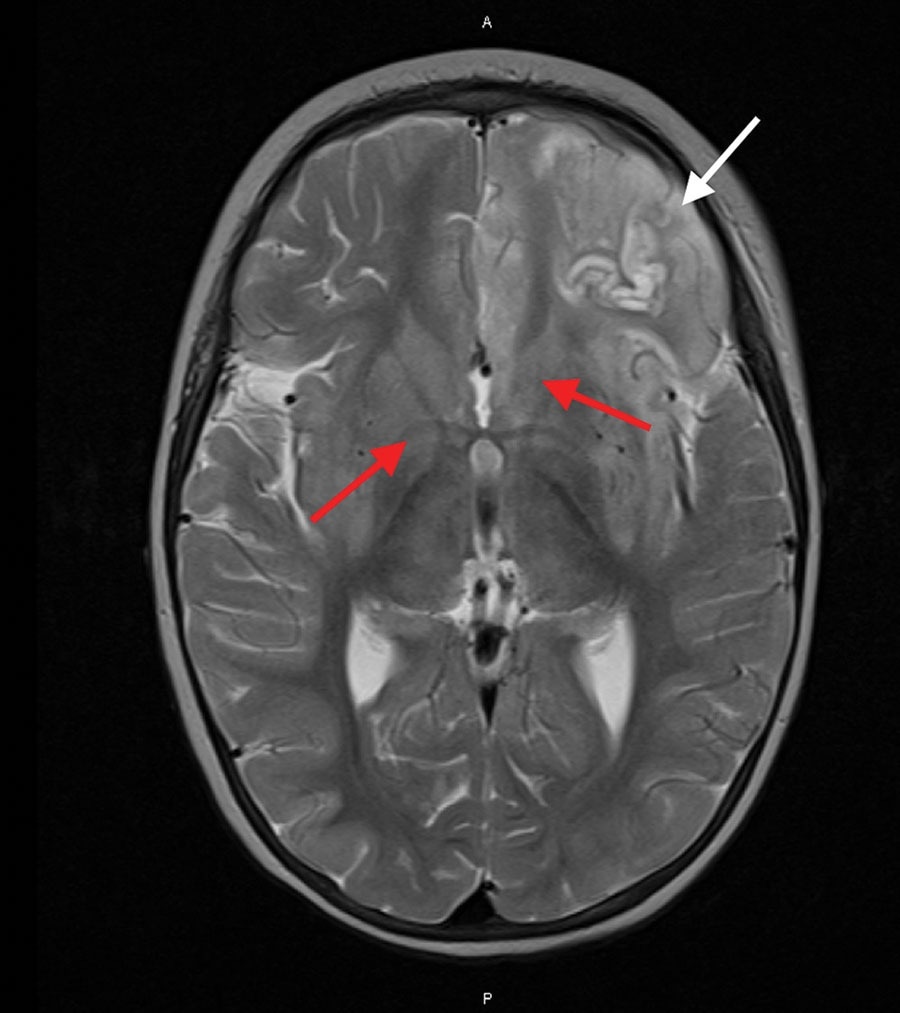
Imagerie par résonance magnétique du cerveau d’un enfant immunodéprimé infecté par le paramyxovirus aviaire de type 1, Australie. L’image prise 16 jours après l’admission à l’hôpital montre une hyperintensité du signal T2 frontal et insulaire majoritairement gauche évoluant vers une nécrose laminaire (flèche blanche) et une hyperintensité des structures profondes de la matière grise (flèches rouges).
Une biopsie cérébrale suivie d’une coloration à l’hématoxyline et à l’éosine des échantillons réalisée 20 jours après l’admission a révélé une nécrose corticale étendue avec un récessus sous-pial limité. Des macrophages mousseux et des cellules T CD3-positives dispersées ont remplacé le cortex, accompagnés de gliose. Les inclusions virales, les nodules microgliaux ou les effets cytopathiques viraux se sont révélés absents. L’immunocoloration NeuN a montré de rares petits neurones restants. Il est important de noter qu’aucun agent pathogène viral n’a été détecté dans le LCR, le plasma ou les tissus cérébraux, ce qui exclut divers virus, dont le coronavirus 2 du syndrome respiratoire aigu sévère (SRAS-CoV-2). Des résultats négatifs ont été obtenus pour les cultures bactériennes et fongiques, la PCR panmycobactérienne et la PCR de l’acide ribonucléique (ARN) ribosomal 16S.
L’état du patient ne s’est pas amélioré malgré un traitement par immunomodulateurs, antimicrobiens, antiépileptiques et un régime cétogène. Une IRM réalisée après deux semaines a montré des modifications inflammatoires progressives et diffuses caractérisées par une hyperintensité croissante des signaux T2 frontaux et insulaires gauches, conduisant à une nécrose laminaire. De plus, une hyperintensité T2 a été observée dans les structures profondes de la matière grise.
Le traitement a été interrompu et le patient est décédé après 27 jours d’hospitalisation. Bien qu’aucune autopsie n’ait été réalisée, des tests métagénomiques agnostiques complets et un séquençage métatranscriptomique impartial ont été réalisés en parallèle sur le tissu cérébral biopsié. Les résultats ont montré la présence dominante d’une souche virulente d’APMV-1 et de faibles niveaux de pégivirus humain (HPgV) sous forme de séquences non humaines. Analyse phylogénétique ont suggéré que le virus provenait d’une lignée australienne putative de PPMV-1 appartenant à la classe II, génotype VI, sous-lignée 2.1.1.2.2.
La PCR quantitative spécifique au virus et l’immunohistochimie ont été utilisées pour confirmer l’infection par l’APMV-1 dans l’échantillon de tissu. Des cellules en grappes nucléoprotéiques et des neurones pyramidaux ont été observés dans l’échantillon de tissu, et aucune coloration n’a été observée dans les contrôles négatifs (cerveau d’adolescent et tissu lymphoïde).
discussion
Des études antérieures ont mis en évidence la virulence et le potentiel du PPMV-1 en matière de maladies graves par rapport aux autres génotypes d’APMV-1. Puisqu’il n’existe actuellement aucun lien connu entre le HPgV et la maladie humaine et qu’aucune autre co-infection n’a été identifiée, le décès du patient a été attribué à une encéphalite due à une infection du SNC par le PPMV-1. Compte tenu des symptômes respiratoires observés chez l’enfant, il est raisonnable de soupçonner que l’infection a débuté au niveau des voies respiratoires supérieures suite à un contact accidentel avec des excréments ou des liquides de pigeon infectés.
Il s’agit du premier rapport établissant un lien entre les incendies et les virus aviaires. Parce que l’AMPV-1 a déjà été utilisé comme agent oncolytique, les chercheurs de la présente étude recommandent un examen attentif de la virulence des différentes souches de ce virus et des effets indésirables potentiels de l’utilisation du PPMV-1.
Diplôme
En résumé, ce cas met en évidence l’interaction complexe entre un traitement antérieur contre la leucémie, les déclencheurs infectieux et les complications neurologiques chez les patients pédiatriques. Cela montre l’importance de l’utilisation Métagénomique dans l’identification de nouveaux agents pathogènes, le diagnostic de cas cliniques complexes et la simplification de l’ensemble du flux de travail. Cependant, l’intégration de la métagénomique dans les diagnostics de routine est limitée par son coût et le besoin de main-d’œuvre qualifiée. Des recherches et développements supplémentaires pour relever ces défis pourraient contribuer à accroître l’accessibilité et le prix abordable de cette technique, améliorant ainsi les résultats pour la santé des patients atteints de maladies infectieuses émergentes.
