Dans une étude récemment publiée dans la revue Métabolisme naturelLes chercheurs ont examiné la sécurité et Efficacité de AMG 133 (Maridebart cafraglutide), une molécule manipulée, pour la perte de poids. Ils ont découvert que l’AMG 133 entraînait une perte de poids dans les systèmes cellulaires et les modèles animaux tout en améliorant les marqueurs métaboliques. De plus, l’AMG 133 a démontré un profil d’innocuité acceptable et une perte de poids significative et dépendante de la dose lors d’un essai clinique de phase 1 mené auprès de participants obèses.
 Étude: Un antagoniste du GIPR conjugué aux analogues du GLP-1 favorise la perte de poids avec des paramètres métaboliques améliorés en milieu préclinique et de phase 1. Crédit photo : White Bear Studio / Shutterstock
Étude: Un antagoniste du GIPR conjugué aux analogues du GLP-1 favorise la perte de poids avec des paramètres métaboliques améliorés en milieu préclinique et de phase 1. Crédit photo : White Bear Studio / Shutterstock
arrière-plan
L’obésité, un problème de santé publique omniprésent, nécessite des thérapies efficaces et sûres. Les traitements à base d’incrétine, en particulier les agonistes du récepteur du peptide-1 de type glucagon (GLP-1R), ont montré une perte de poids et des avantages cardiovasculaires significatifs. Cependant, il reste un besoin pour des traitements contre l’obésité plus efficaces, avec des dosages moins fréquents et une meilleure tolérance. Pour répondre à ce besoin, les chercheurs ont étudié l’utilisation de peptides agonistes multispécifiques contre le GLP-1 et les peptides inhibiteurs gastriques (GIP).
Des études pangénomiques ont confirmé la contribution du locus du récepteur GIP (GIPR) à la régulation du poids corporel. Les molécules bispécifiques développées en combinant l’antagonisme du GIPR et l’agonisme du GLP-1R ont montré des résultats précliniques prometteurs, conduisant à une perte de poids et à des améliorations métaboliques chez les souris et les singes obèses. L’AMG 133 est l’une de ces molécules bispécifiques développées en conjuguant un anticorps monoclonal GIPR humain avec deux peptides agonistes analogues du GLP-1. Les enquêteurs de la présente étude ont étudié l’innocuité, les propriétés pharmacologiques et l’efficacité de l’AMG 133 en milieu préclinique et clinique.
À propos de l’étude
Dans la présente étude, l’AMG 133 a été synthétisé sous forme de conjugué anticorps-peptide utilisant un lieur d’acide aminé et ses propriétés pharmacocinétiques (PK) ont été caractérisées. in vitro. Les tests fonctionnels cellulaires impliquaient l’utilisation de cellules recombinantes de rein embryonnaire humain (HEK) 293T exprimant le GIPR humain ou de singe cynomolgus et de cellules d’ovaire de hamster chinois (CHO) exprimant le GIPR de rat ou de souris. L’accumulation d’adénosine monophosphate cyclique (AMPc) a été mesurée. Les propriétés pharmacocinétiques de l’AMG 133 intact et total ont été évaluées en injectant la molécule à des souris et à des singes cynomolgus femelles obèses.
Dans la partie clinique de l’étude, une étude de phase 1 randomisée et contrôlée par placebo a été réalisée. Expérience en double aveugle a été menée pour évaluer la tolérabilité, l’innocuité, la pharmacocinétique et la pharmacodynamique (PD) de doses uniques croissantes (SAD) et de doses multiples croissantes (MAD) d’AMG 133 chez les adultes obèses. Alors que les critères d’évaluation principaux étaient l’innocuité et la tolérabilité, les critères d’évaluation secondaires étaient la pharmacocinétique et l’immunogénicité. De plus, les biomarqueurs de la MP (y compris le poids) ont été considérés comme critères d’évaluation exploratoires.
Dans sept cohortes SAD, 49 participants obèses ont été recrutés et randomisés pour recevoir de l’AMG 133 (21 à 840 mg) ou un placebo pendant 150 jours maximum. L’âge moyen de ces participants était de 45,5 à 53,8 ans et leur indice de masse corporelle (IMC) était de 32,5 à 34,8 kg m−2 Dans trois cohortes MAD, 26 participants obèses ont été recrutés et randomisés pour recevoir de l’AMG 133 (140, 280 ou 420 mg) ou un placebo pendant 207 jours maximum. L’âge moyen de ces participants était de 40,3 à 51,6 ans et leur IMC était de 32,5 à 34,2 kg m−2. Aucun des participants n’avait d’antécédents de diabète sucré.
Résultats et discussion
Le poids moléculaire de l’AMG 133 était de 153 514 Da. Dans les tests cellulaires, l’AMG 133 a montré une activité antagoniste contre le GIPR des humains, des singes cynomolgus et des rats. Le substitut de souris AMG 133 pourrait réduire la consommation alimentaire et la glycémie et entraîner une perte de poids chez la souris. Des améliorations dose-dépendantes de la glycémie, de l’insuline plasmatique et des taux de lipides ont également été observées. Le traitement par AMG 133 chez des singes obèses a entraîné une réduction du poids corporel, de l’apport énergétique total, des triglycérides à jeun, de l’insuline et du cholestérol après six semaines.
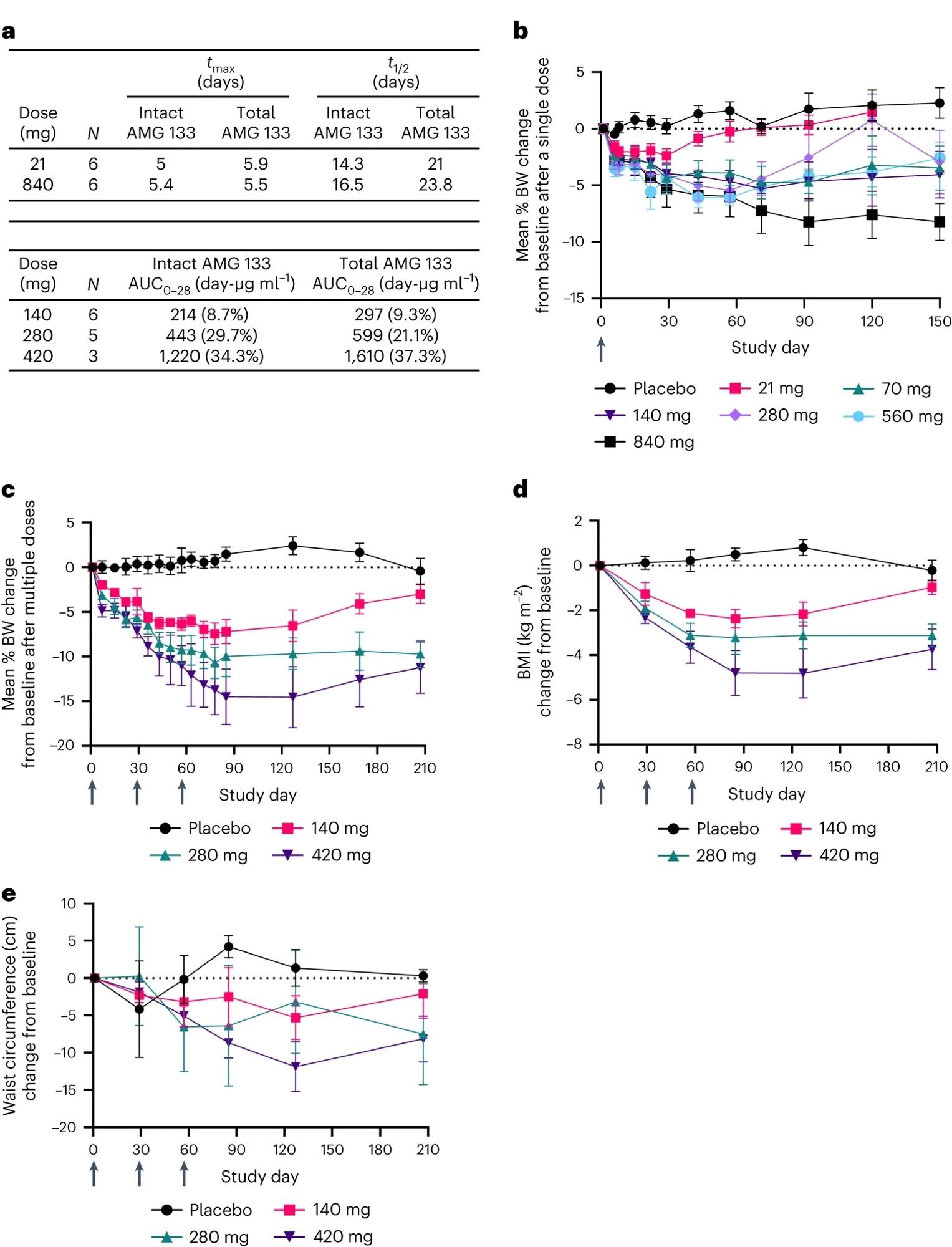 UN, Paramètres AMG 133 PK ; TMax. est représenté comme médiane et t1/2 est représenté comme une moyenne géométrique. AUC0-28 est présenté sous forme de moyenne géométrique (CV%) après la dernière dose d’AMG 133 au jour 57 pour les cohortes MAD. b–eVariation moyenne (sem) en pourcentage du poids corporel par rapport à la valeur initiale après des doses uniques, n = 6 à 7 pour l’AMG 133 et n = 12 pour le placebo au jour 1 (b) et doses multiples, n = 6 à 8 pour AMG 133 et n = 6 pour le placebo au jour 1 (C). Modification moyenne (sem) de l’IMC par rapport à la valeur initiale, n = 6 à 8 pour AMG 133 et n = 6 pour le placebo au jour 1 (D) et tour de taille, n = 6-8 pour AMG 133 et n = 6 pour le placebo au jour 1 (e) après plusieurs doses d’AMG 133. Les flèches indiquent le moment où le médicament expérimental a été administré : le jour 1 dans les cohortes SAD (b) et aux jours 1, 29 et 57 dans les cohortes MAD (C–e).
UN, Paramètres AMG 133 PK ; TMax. est représenté comme médiane et t1/2 est représenté comme une moyenne géométrique. AUC0-28 est présenté sous forme de moyenne géométrique (CV%) après la dernière dose d’AMG 133 au jour 57 pour les cohortes MAD. b–eVariation moyenne (sem) en pourcentage du poids corporel par rapport à la valeur initiale après des doses uniques, n = 6 à 7 pour l’AMG 133 et n = 12 pour le placebo au jour 1 (b) et doses multiples, n = 6 à 8 pour AMG 133 et n = 6 pour le placebo au jour 1 (C). Modification moyenne (sem) de l’IMC par rapport à la valeur initiale, n = 6 à 8 pour AMG 133 et n = 6 pour le placebo au jour 1 (D) et tour de taille, n = 6-8 pour AMG 133 et n = 6 pour le placebo au jour 1 (e) après plusieurs doses d’AMG 133. Les flèches indiquent le moment où le médicament expérimental a été administré : le jour 1 dans les cohortes SAD (b) et aux jours 1, 29 et 57 dans les cohortes MAD (C–e).
Dans l’essai clinique de phase 1, l’AMG 133 a démontré un profil d’innocuité et de tolérabilité acceptable. Les paramètres de laboratoire de sécurité clinique (électrolytes, fonction rénale et hématologie) et les paramètres de l’échocardiogramme n’ont montré aucune différence significative entre les groupes de traitement. Aucun événement indésirable (EI) grave ou grave n’a été signalé. Les effets indésirables les plus fréquents étaient de légers symptômes gastro-intestinaux, principalement des nausées et des vomissements, qui disparaissaient généralement dans les 48 heures. Bien qu’une réduction des taux de glucose à jeun ait été observée, aucun événement lié à l’hypoglycémie n’a été signalé.
De plus, aucun changement cliniquement significatif de la pression artérielle n’a été observé avec AMG 133 et des augmentations de la fréquence cardiaque dans les limites de la normale ont été notées. Le traitement par AMG 133 a entraîné une augmentation des acides gras libres, en particulier dans le groupe 420 mg. Des diminutions transitoires du cholestérol total, des lipoprotéines de basse densité et des triglycérides ont été observées dans tous les groupes (y compris le placebo).
L’AMG 133 a montré une augmentation proportionnelle à la dose, les concentrations plasmatiques maximales atteignant environ 4 à 7 jours après l’administration dans la cohorte SAD et 4 à 6 jours dans la cohorte MAD. La demi-vie moyenne de l’AMG 133 intact était comprise entre 14 et 16 jours et celle de l’AMG 133 total était comprise entre 21 et 24 jours.
Il est important de noter que le traitement par AMG 133 a réduit de manière dose-dépendante le poids corporel moyen, l’IMC et le tour de taille des participants par rapport à la ligne de base.
Diplôme
En conclusion, les résultats de cette étude suggèrent que l’AMG 133 pourrait être une option thérapeutique potentiellement viable pour le contrôle du poids en raison de son profil d’innocuité favorable, de sa demi-vie prolongée et de sa perte de poids significative et soutenue. Des investigations plus approfondies dans le cadre d’un essai clinique de phase 2 sont nécessaires pour confirmer ces résultats.
Référence du magazine :
- Un antagoniste du GIPR conjugué aux analogues du GLP-1 favorise la perte de poids avec des paramètres métaboliques améliorés dans les contextes précliniques et de phase 1. Véniant, MM et al., Métabolisme naturel (2024), DOI : 10.1038/s42255-023-00966-w, https://www.nature.com/articles/s42255-023-00966-w
