Un récent Vieillissement naturel L’étude évalue l’efficacité de la thérapie sénolytique basée sur les cellules T du récepteur d’antigène chimérique (CAR). Dans cette thérapie, les cellules CAR-T sénolytiques ciblent les cellules positives du récepteur activateur du plasminogène de l’urokinase (uPAR) qui s’accumulent au cours du vieillissement.
 Étude: Efficacité prophylactique et durable des cellules CAR-T sénolytiques contre les troubles métaboliques liés à l’âge. Crédit photo : Juan Gaertner / Shutterstock.com
Étude: Efficacité prophylactique et durable des cellules CAR-T sénolytiques contre les troubles métaboliques liés à l’âge. Crédit photo : Juan Gaertner / Shutterstock.com
arrière-plan
La sénescence cellulaire est un arrêt irréversible du cycle cellulaire induit en réponse à un stress. Dans des conditions de stress, des enzymes de remodelage matriciel et des cytokines pro-inflammatoires sont produites, appelées phénotype sécrétoire associé à la sénescence (SASP).
Chez les jeunes présentant des conditions physiologiques telles que la suppression de tumeurs et la cicatrisation des plaies, le SASP soutient le recrutement de cellules immunitaires qui facilitent la réparation tissulaire et l’élimination des cellules sénescentes. Les personnes âgées subissent une accumulation de cellules sénescentes en raison d’une fonction réduite du système immunitaire et de lésions tissulaires plus importantes.
À ce jour, la plupart des thérapies au sénoylate impliquent des médicaments à petites molécules qui nécessitent une administration répétée et ciblent mal la région affectée. En comparaison, les cellules CAR T nécessitent un antigène cible unique qui est exprimé différemment par rapport aux tissus normaux. De plus, les cellules CAR-T sont des « médicaments vivants » qui sont administrés une seule fois et persistent et exercent leurs effets pendant de nombreuses années.
À propos de l’étude
Il a déjà été démontré que les cellules CAR-T ciblent la protéine de surface cellulaire uPAR et déciment efficacement les cellules sénescentes. L’étude actuelle vérifie si les cellules CAR T éliminent efficacement et en toute sécurité les cellules sénescentes chez les vieilles souris et régulent ainsi la santé.
Des souris des deux sexes âgées de 8 à 12 semaines et de 18 à 20 mois ont été incluses dans l’étude. Ils ont été gardés dans des logements collectifs et dans des conditions exemptes d’agents pathogènes.
Un cycle lumière/obscurité de 12 heures a été utilisé et les conditions de température et d’humidité étaient standard. Les souris plus âgées suivaient un régime alimentaire normal, tandis qu’un sous-ensemble de souris suivait un régime riche en graisses (HFD).
Pour l’analyse cytométrique en flux, les foies ont été dissociés et filtrés, suivis d’une lyse des globules rouges. Le séquençage de l’acide ribonucléique (ARN) unicellulaire a été réalisé, suivi de l’expansion, de l’isolement et de la transduction de cellules T de souris. Des analyses de sang complètes ont été effectuées et une autopsie multi-organes a été réalisée.
Principales conclusions
Il a été démontré que les thérapies cellulaires sénolytiques atténuent les symptômes associés au vieillissement physiologique, notamment les troubles métaboliques. À cette fin, la proportion de cellules uPAR-positives augmente souvent avec l’âge ; Par conséquent, les cellules uPAR-positives, immunologiques et non immunitaires, allègent probablement le fardeau de la sénescence dans les tissus âgés.
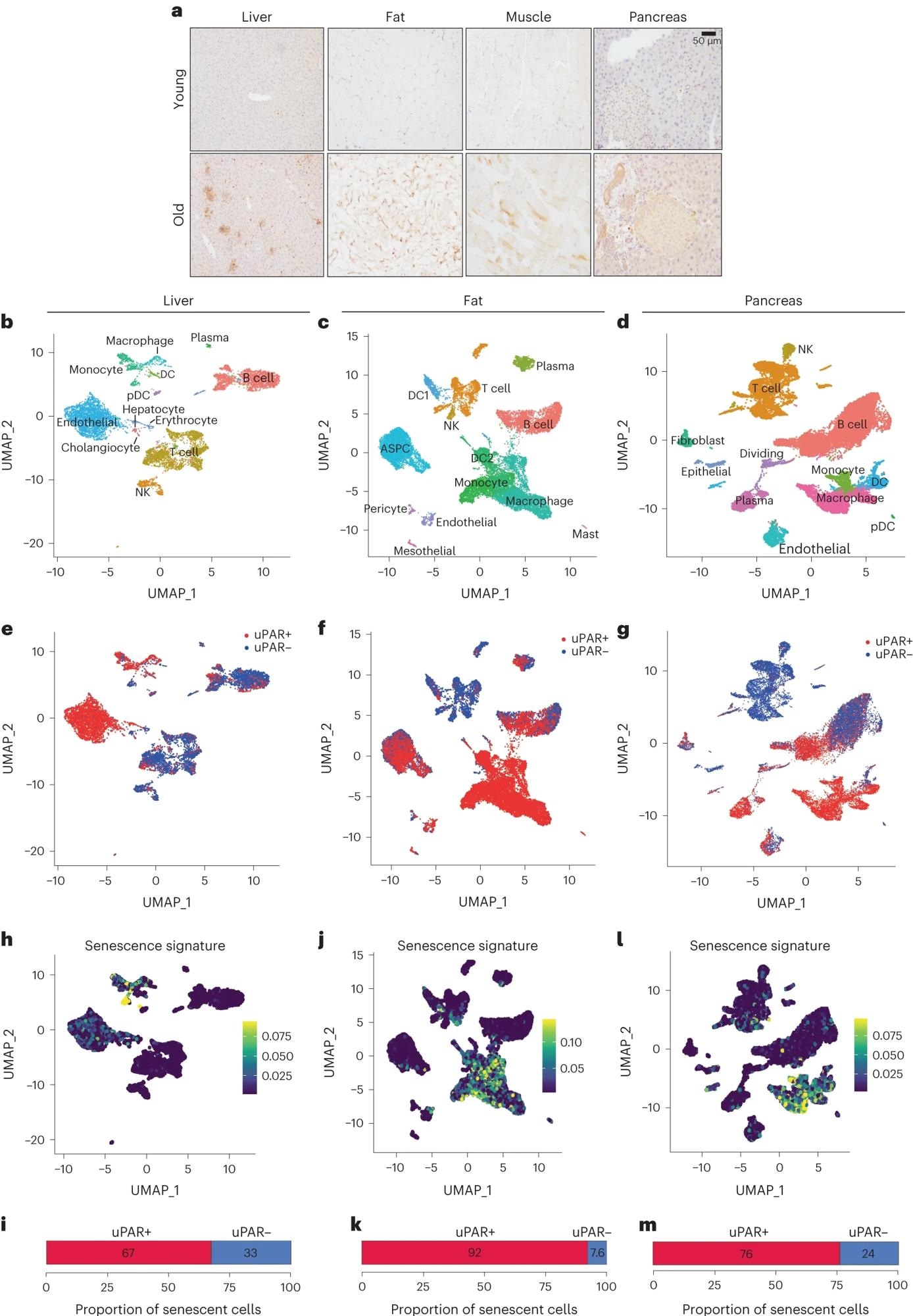
UNColoration immunohistochimique de l’uPAR de souris dans le foie, le tissu adipeux, les muscles et le pancréas de souris jeunes (3 mois) ou âgées (20 mois) (n = 3 par âge). b–M, Analyse unicellulaire de l’expression et de la sénescence de uPAR. Les cellules uPAR-positives et uPAR-négatives ont été triées à partir du foie, du tissu adipeux et du pancréas de souris âgées de 20 mois et soumises à un séquençage d’ARN unicellulaire selon le protocole 10x-Chrome (n = le séquençage de quatre souris dans lesquelles il y avait deux femelles). combinés en une répétition et deux mâles ont été combinés en une autre répétition). bVisualisation par approximation et projection uniforme du collecteur (UMAP) des types de cellules hépatiques. CVisualisation UMAP des types de cellules du tissu adipeux. DVisualisation UMAP des types de cellules pancréatiques. eVisualisation UMAP des types de cellules hépatiques uPAR négatives et uPAR positives. FVisualisation UMAP des types d’adipocytes uPAR-négatifs et uPAR-positifs. gVisualisation UMAP des types de cellules pancréatiques uPAR négatives et uPAR positives. H,J.,jeVisualisations UMAP avec scores de signature de sénescence24 dans chaque cellule indiquée par l’échelle de couleurs. je,k,MQuantification de la proportion de cellules uPAR-positives et uPAR-négatives contribuant à la signature de sénescence respective. H,jeFoie; J.,ktissu adipeux; je,M, pancréas. Les résultats proviennent d’une expérience indépendante (UN–M). DC, cellule dendritique ; NK, tueur naturel ; pDC, cellule dendritique plasmacytoïde ; ASPC, progéniteurs adipeux et cellules souches.
L’efficacité de L’élimination des cellules sénescentes uPAR-positives par les cellules uPAR-CAR-T a également été mise en évidence. À cette fin, l’efficacité des cellules uPAR-CAR-T n’est pas liée à la pathologie tissulaire ou aux modifications des paramètres rénaux et hépatiques chez les souris âgées.
L’effet des cellules uPAR-CAR-T s’est avéré lié à la forme métabolique et à l’augmentation de l’homéostasie du glucose chez les souris vieillissantes normales et nourries avec HFD. Il est important de noter qu’aucune toxicité n’a été observée après l’administration de cellules uPAR CAR T aux doses recommandées.
Une autre observation notable était le potentiel des cellules uPAR-CAR-T à agir de manière prophylactique pour atténuer le déclin métabolique lié à l’alimentation et à l’âge. De plus, les cellules uPAR-CAR-T ont des effets durables sur les méthodes sénolytiques basées sur de petites molécules. Après une seule administration, ces cellules ont altéré le syndrome métabolique lié au HFD ou à l’âge chez les souris ayant reçu du HFD ou traitées à l’adolescence.
Concernant la tolérance au glucose, des études sénolytiques ont noté l’élimination des cellules bêta pancréatiques sénescentes. Cependant, la sénescence des cellules immunitaires pourrait également avoir joué un rôle.
Il a également été suggéré que l’élimination des macrophages présentant des caractéristiques sénescentes pourrait atténuer la perte de tissus chez la souris. Ceci est cohérent avec les observations de l’étude dans lesquelles une proportion de macrophages exprimant uPAR co-expriment des signatures transcriptionnelles associées à la sénescence et à la β-galactosidase associée à la sénescence (SA-β-gal).
Conclusions
Le mécanisme d’action des petites molécules est souvent mal compris ; Cependant, il existe un mécanisme clair sous-jacent aux cellules CAR-T sénolytiques en raison de l’expression de surfaces spécifiques. Antigènes. Cette approche présente de nombreux avantages par rapport aux approches de vaccination ou aux petites molécules, car les thérapies cellulaires régulent la persistance grâce à différentes conceptions de CAR et sont équipées de commutateurs de sécurité spécifiques.
À l’avenir, la thérapie cellulaire pourrait cibler ces antigènes pour traiter différents phénotypes. La durabilité de l’effet et la persistance des cellules CAR T ciblées par uPAR après une seule administration sont de bon augure pour le CAR sénolytique Cellule T Approche du traitement des pathologies chroniques.
Référence du magazine :
- Amor, C., Fernandez-Maestre, I., Chowdhury, S., et coll. (2024) Efficacité prophylactique et durable des cellules CAR-T sénolytiques contre les troubles métaboliques liés à l’âge. Vieillissement naturel; 1-14. est ce que je:10.1038/s43587-023-00560-5