Dans une étude récemment publiée dans la revue Avancées scientifiques, les chercheurs ont mené diverses expériences sur des lignées cellulaires humaines et des modèles de souris transgéniques pour étudier le lien entre la protéine de réparation de l’ADN Ku70 et le cancer du côlon. Leurs résultats soulignent la forte fonction suppressive de tumeur de la protéine. Les mutations du gène codant pour la protéine ou la régulation négative de l’expression augmentaient considérablement le risque de cancer colorectal spontané ultérieur. Le risque de colite et de cancer colorectal associé à la colite était également augmenté.
Cette étude favorise les progrès dans la compréhension de la voie de signalisation Ras-ERK médiée par Ku70 et des mécanismes moléculaires de l’activation de Ku70. Ceux-ci pourraient à leur tour constituer la base du développement futur de thérapies basées sur l’ADN.
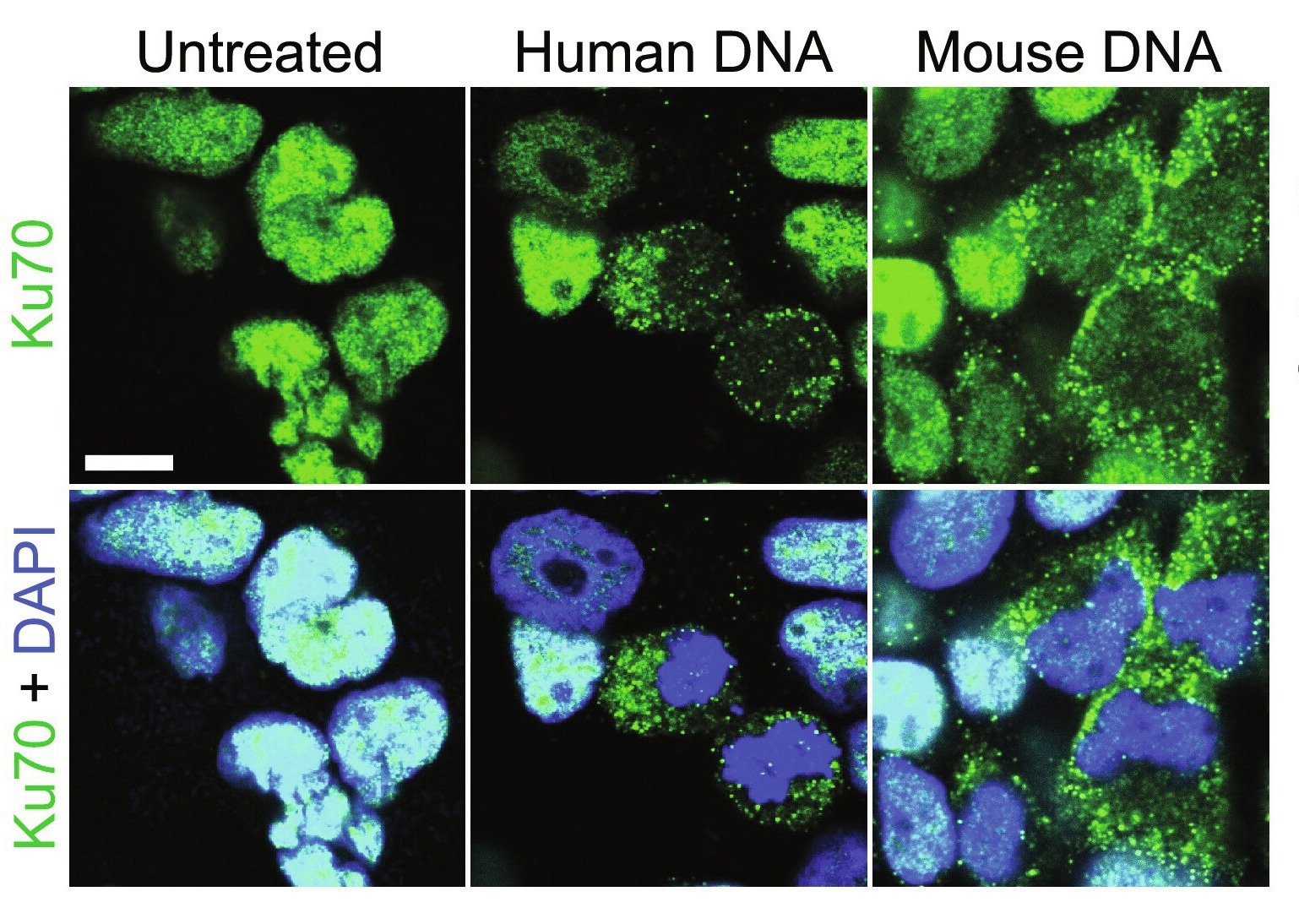 Étude: Ku70 reconnaît l’ADN cytosolique et assemble un signalosome suppresseur de tumeur
Étude: Ku70 reconnaît l’ADN cytosolique et assemble un signalosome suppresseur de tumeur
Qu’est-ce que le Ku70 ?
Ku70 est une protéine de sous-unité de réparation de l’ADN qui prend en charge la réparation de l’ADN via la voie de jonction d’extrémités non homologues (NHEJ). Chez l’homme, la protéine est codée par le gène XRCC6, dont les études montrent qu’il est conservé au cours de l’évolution. Ku70 est présent à la fois dans le noyau et dans le cytoplasme et était jusqu’à récemment considéré comme limité à son rôle principal (réparation de l’ADN). Cependant, au cours de la dernière décennie, un nombre croissant de publications ont mis en évidence les fonctions secondaires des protéines, notamment les fonctions antimicrobiennes et antitumorales.
Il a été démontré que le Ku70 cytoplasmique produit des interférons de type III (IFN) en réponse à l’ADN bactérien ou viral dans des systèmes modèles humains et murins. Il a également été démontré qu’il se lie à Rickettsia conorii, un pathogène bactérien humain, facilitant sa neutralisation par les cellules de mammifères non phagocytaires.
Récemment, des recherches ont montré que la protéine pourrait également jouer un rôle suppresseur de tumeur. Dans une expérience indépendante, des souris génétiquement modifiées dépourvues du gène Ku70 se sont révélées remarquablement sensibles au carcinome hépatocellulaire et au cancer spontané. Cellule T Développement du lymphome. Une autre étude a révélé que la suppression génétique de Ku70 augmentait le risque de cancer du côlon. Malheureusement, le gène Ku70 est impliqué dans la croissance et sa suppression entraîne un retard de croissance chez la souris. Parce qu’une taille corporelle plus petite et une croissance faible auraient rendu difficile l’interprétation de ces résultats, le lien entre Ku70 et le cancer reste spéculatif et jusqu’à présent non confirmé.
À propos de l’étude
La présente étude vise à élucider un lien entre l’expression de la protéine Ku70 et le risque de cancer colorectal. Une fois l’association identifiée, le mécanisme soulignant le rôle antitumoral protecteur de Ku70 sera étudié. Le groupe d’échantillons expérimentaux était composé de types sauvages (WT), Ku70+/−(hétérozygote pour Ku70), Ku70−/−(homozygotes récessives) et souris transgéniques C57BL/6NcrlAnu. Les quatre types de souris ont été divisés à parts égales en cohortes de cas (AOM-DSS) et témoins (non traitées).
L’étude a commencé par l’induction expérimentale de la colite et de la tumorigenèse colorectale associée à la colite dans la cohorte de cas par injection intrapéritonéale de 10 mg d’azoxyméthane (AOM). Cinq jours plus tard, du sulfate de dextrane sodique à 1,5 % (DSS) a été administré pendant six jours. Quatorze jours après l’administration de l’AOM, les souris ont été euthanasiées et leurs tissus intestinaux et côlons ont été collectés pour validation méthodologique et analyse en aval.
Les cancers induits ont été identifiés et caractérisés à l’aide de techniques histologiques, immunohistochimiques et microscopiques. Ku70 et les protéines apparentées (par exemple, les cytokines) ont été identifiées et quantifiées à l’aide d’immunotransferts et de tests immunoenzymatiques (ELISA), respectivement. La réaction quantitative en chaîne par polymérase en temps réel (qRT-PCR) a été utilisée pour isoler, amplifier et identifier l’ARN d’intérêt dans le tissu du côlon. L’ARN a ensuite été purifié par précipitation avec du chlorure de lithium (LiCl). L’ADN génomique obtenu à partir des selles de souris a été utilisé pour identifier et caractériser les assemblages du microbiome intestinal à l’aide du séquençage du gène de l’ARN ribosomal 16S (ARNr).
Séparément, des éléments de preuve basés sur des lignées cellulaires ont été obtenus en construisant un plasmide contenant le gène Ku70, qui a ensuite été transformé en NEB 5-alpha compétent. Escherichia coli. Enfin, le recombinant E. coli a été utilisé pour transfecter les sujets, à savoir les lignées cellulaires HEK293T humaines et les cellules du côlon cultivées à partir de tissus du côlon récoltés.
Les analyses de lignées cellulaires comprenaient des techniques de génomique, d’immunotransfert et d’immunofluorescence utilisées pour les modèles de souris, ainsi que des analyses de co-immunoprécipitation, de prolifération et de culture organoïde. Le RAS actif a été examiné comme variable confondante à l’aide du kit de détection Active Ras. Le RAS est une famille de gènes dont les mutations seraient responsables de 95 % des cancers du pancréas et de 45 % des cancers colorectaux.
Résultats de l’étude
Le point culminant de cette étude est la confirmation que le capteur d’ADN cytosolique Ku70 joue le rôle secondaire de suppression tumorale. Une réduction de l’expression de Ku70 ou une mutation de son gène a rapidement conduit à une tumorigenèse dans les modèles murins et dans les cultures cellulaires. Cette étude décrypte davantage le mécanisme d’action de Ku70 et montre une cooccurrence étonnamment élevée de mutations avec des gènes codant pour ARAF, RAF1, HRAS, NRAS et BRAF, des gènes de la famille RAS précédemment impliqués dans le cancer colorectal.
“Notre étude suggère que la voie Ku70-ERK supprime la tumeur, ce qui contraste avec l’observation selon laquelle les mutations Ras/Raf, courantes dans le cancer colorectal, provoquent une activation aberrante de la voie ERK-MAPK en aval.”
Les résultats de l’étude suggèrent également que Ku70 pourrait fonctionner d’une manière spécifique à chaque cellule : les cellules épithéliales et stromales de patients atteints de la maladie de Crohn ou d’un cancer colorectal présentent une expression réduite du gène Ku70, même dans des conditions homozygotes dominantes. En parallèle, Ku70 s’est avéré former un signalosome cytosolique composé de Ras, Raf et Ku70, qui s’ancre à la membrane de l’endosome et médie l’activation de l’axe de signalisation MEK-ERK-Cdc25A-CDK1, entraînant un effet antitumorigène.
«… L’activation de la voie Ras-ERK protège les souris de la colite (83) et inhibe la prolifération des cellules de mammifères. D’autres études sont nécessaires pour clarifier quels types de cellules subissent le signal Ras-ERK pour la progression du cancer colorectal et quels types de cellules subissent le signal Ku70 pour la progression du cancer colorectal.
« Nous pensons que l’activation de la signalisation Ras-ERK médiée par Ku70 pourrait être déclenchée par l’ADN cytoplasmique dérivé du microbiome intestinal et introduit dans les cellules hôtes suite à une perturbation de la barrière intestinale. Cependant, il est également possible que les noyaux cellulaires endommagés et…”/ou les mitochondries soient une source d’ADN cytoplasmique qui déclenche la signalisation Ras-ERK médiée par Ku70.”
Référence du magazine :
- Pandey, A., Shen, C., Feng, S., Tuipulotu, DE, Ngo, C., Liu, C., Kurera, M., Mathur, A., Venkataraman, S., Zhang, J., Talaulikar , D., Song, R., Wong, L., Teoh, N., Kaakoush, NO et Man, SM (2024). Ku70 reconnaît l’ADN cytosolique et assemble un signalosome suppresseur de tumeur. Avancées scientifiques, EST CE QUE JE – 10.1126/sciadv.adh3409, https://www.science.org/doi/10.1126/sciadv.adh3409
