Les globules blancs, ou leucocytes, constituent la première et la deuxième lignes de défense de l’organisme contre les organismes et particules étrangers. Cependant, peu de médicaments ciblent la production et le mouvement de ces cellules à des fins cliniquement utiles. Une nouvelle étude a été publiée dans la revue immunité explore le paysage des molécules de signalisation pour identifier des cibles médicamenteuses potentielles pour la migration des leucocytes dans la circulation sanguine.
 Étude: L’inhibition de la petite molécule histone acétyltransférase CBP/p300 mobilise les leucocytes de la moelle osseuse via la réponse endocrinienne au stress. Crédit photo : Rost9 / Shutterstock
Étude: L’inhibition de la petite molécule histone acétyltransférase CBP/p300 mobilise les leucocytes de la moelle osseuse via la réponse endocrinienne au stress. Crédit photo : Rost9 / Shutterstock
Les leucocytes, notamment les neutrophiles, les monocytes et les lymphocytes B, se forment dans la moelle osseuse à partir de cellules progénitrices hématopoïétiques et dans certains autres organes spécialisés. Ils sont retenus dans la moelle osseuse jusqu’à ce qu’ils soient libérés dans la circulation.
Il existe deux compartiments leucocytaires dans le sang et les tissus périphériques, dont la taille change en fonction de l’état corporel. Par exemple, lorsque le corps est blessé, stressé ou infecté, le nombre de leucocytes dans les tissus affectés change et revient à la normale une fois la menace contenue.
Plusieurs étapes de régulation sont impliquées dans la dégradation et le déplacement des leucocytes vers différents endroits où ils sont nécessaires. Ceux-ci surviennent dans le système nerveux central (SNC) en réponse à des signaux périphériques et sont régulés par des circuits neuronaux impliquant à la fois le système nerveux sympathique et l’axe hypothalamo-hypophyso-surrénalien (HPA).
Ces signaux augmentent la production de sang dans la moelle osseuse, recrutent des leucocytes dans le sang et d’autres tissus là où ils sont nécessaires et garantissent qu’ils reviennent à des niveaux normaux une fois le défi surmonté.
Dans certains états pathologiques, ce contrôle homéostatique est perdu, ce qui entraîne des comptes anormaux, tels que : B. Insuffisance médullaire d’une part ou leucémie aiguë d’autre part. Cependant, jusqu’à présent, seuls quelques médicaments peuvent aider à corriger une telle dérégulation en modifiant le taux de production, de dégradation ou de migration des leucocytes, qu’il s’agisse d’un cancer du sang, d’une inflammation chronique ou d’états hyperinflammatoires aigus.
Les médicaments disponibles comprennent la famille du facteur de stimulation des colonies de granulocytes (G-CSF), les antagonistes du récepteur de chimiokine 4 à motif CXC (CXCR4) tels que Plerixafor/AMD3100 ou les inhibiteurs très tardifs de l’intégrine. antigène 4 (VLA4). Par exemple, le G-CSF est utilisé pour corriger la neutropénie chez les patients recevant une chimiothérapie, mais est moins utile chez les patients souffrant d’états fébriles aigus avec un faible nombre de neutrophiles. De plus, le G-CSF peut provoquer des effets secondaires chez certains patients.
La nécessité d’en savoir plus sur ce domaine de la pharmacologie a motivé la présente étude. Il se concentre sur une petite molécule appelée protéine p300 associée à E1A (EP300 ou p300), qui semble avoir été nouvellement acquise au cours de la phase de leucémie d’une maladie appelée neutropénie congénitale sévère (SCN).
La perte de fonction de ce gène a entraîné une réduction de la production de cellules sanguines lorsqu’il est supprimé avant la naissance, mais un nombre de leucocytes élevé ou leucémique plus tard dans la vie. Celui-ci possède une protéine de liaison à l’élément de réponse à l’adénosine monophosphate cyclique orthologue (CREBBP, également connue sous le nom de « CBP ») avec une homologie de séquence de 90 %. L’un des 8 domaines de ce gène est responsable de l’histone acétyltransférase (HAT). activité et contient une mutation dans le SCN qui provoque une transformation leucémique.
Dans ce cas, ce domaine pourrait être drogué en «Leucocytose si nécessaire” en modifiant la taille des différents compartiments leucocytaires.
Qu’a montré l’étude ?
Les scientifiques ont découvert que l’inhibition du domaine CBP/p300 avec son activité HAT par l’inhibiteur de petite molécule A485 entraînait une inhibition compétitive réversible de l’activité enzymatique de la HAT, en particulier pour la CBP et la p300, par rapport aux autres HAT. Comme prévu, cela a conduit à une augmentation rapide des niveaux d’acétyl-CoA dans les macrophages de la moelle osseuse chez les modèles murins. Le résultat fut une leucocytose rapide.
L’effet s’est avéré dépendant de la dose et n’a pas diminué avec des administrations répétées. Lors de l’utilisation d’un autre type d’inhibiteur CBP/p300 HAT (C646), le même effet a été observé, confirmant le mécanisme d’action. En revanche, les inhibiteurs de la liaison de l’ADN par la protéine ou une autre THA trouvée chez les mammifères n’ont pas provoqué de leucocytose.
Les niveaux d’A485 dans le sang ont augmenté rapidement lorsqu’ils ont été injectés à des souris et se sont accumulés dans la moelle osseuse, les tissus adipeux, le foie, la rate et les reins, mais pas dans le cerveau. En parallèle, le nombre de leucocytes a augmenté, notamment les neutrophiles, les lymphocytes et les monocytes. Une semaine plus tard, il n’y avait aucun signe d’administration du médicament, ce qui suggère un effet passager.
L’augmentation du nombre de leucocytes était comparable à celle obtenue avec le G-CSF, mais légèrement plus rapide pour les neutrophiles. Lorsque les deux étaient administrés, le nombre de neutrophiles était significativement plus élevé. Cependant, après 24 heures, les trois types de cellules sanguines ont été cultivés avec G-CSF versus A485.
Cela indique un effet plus court et différent de l’A485 par rapport au G-CSF.
Pour étendre les observations aux sujets humains, les chercheurs ont examiné les données d’une cohorte de patients atteints d’une maladie rare appelée syndrome de Rubinstein-Taybi (RSTS). CREBBP Et EP300 Des mutations se produisent. Environ les deux tiers avaient un nombre de leucocytes élevé, dont 70 % présentaient des mutations dans le domaine HAT. Comme prévu, ce groupe présentait une leucocytose plus fréquemment que l’autre groupe dans lequel la THA était épargnée.
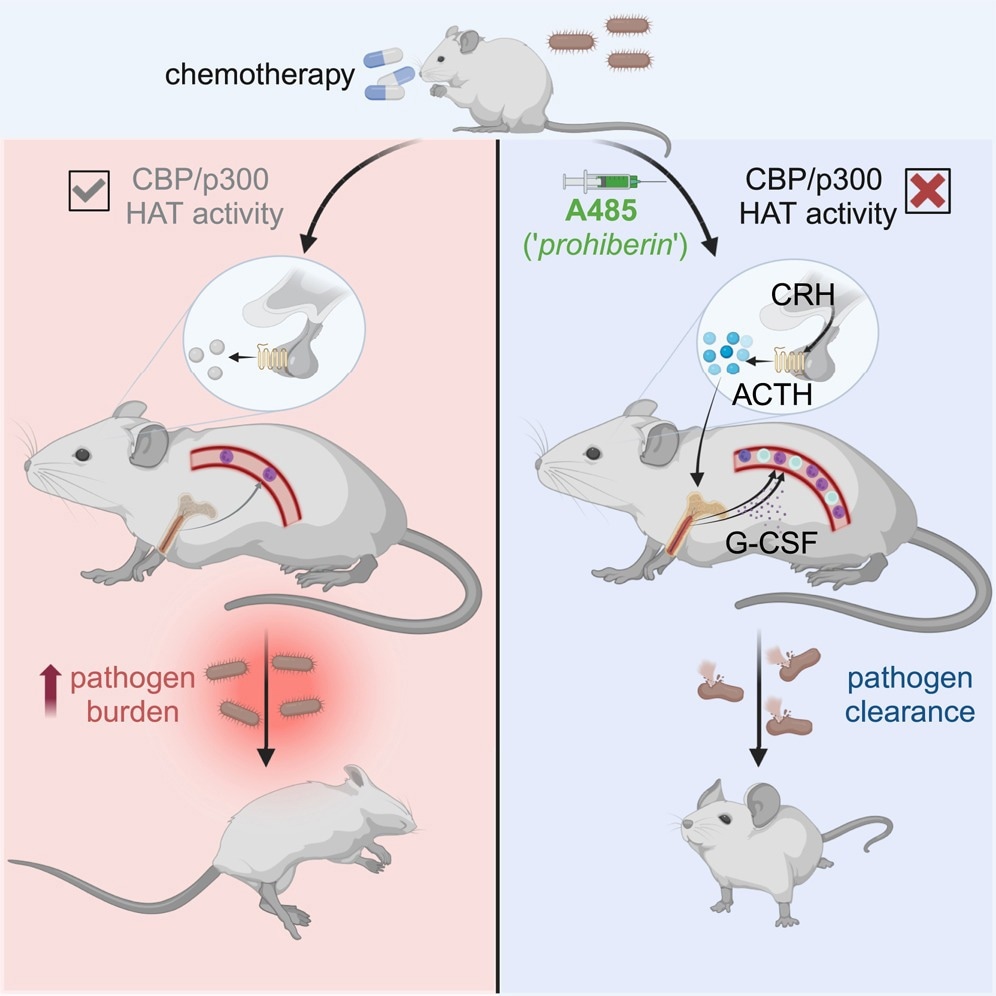
Cette observation a-t-elle une utilité clinique ? Pour le savoir, ils ont testé les effets de l’A485 sur une cohorte de souris atteintes du syndrome myélodysplasique (SMD) et ont découvert que la petite molécule maintenait le nombre de leucocytes à un niveau normal. Deuxièmement, ils ont induit une neutropénie sévère par chimiothérapie sur un modèle murin, montrant que l’A485 entraînait une récupération aiguë du nombre de leucocytes.
Puis ils ont introduit l’organisme Listeria monocytogènes à une dose induisant un sepsis chez des souris atteintes de pancytopénie induite par la chimiothérapie. Les neutrophiles jouent un rôle crucial dans la défense immunitaire contre ce microbe. Après le début de l’infection, ils ont injecté aux sujets témoins de l’A485 au lieu du véhicule.
Alors que les personnes traitées avec le véhicule sont tombées malades et sont mortes d’une septicémie, l’A485 en dose unique a entraîné une amélioration des taux de survie car moins de bactéries ont été détectées chez les animaux traités. A485 mobilise les leucocytes de la moelle osseuse, ce qui représente le mécanisme de la leucocytose. Cependant, il n’y a pas eu d’hématopoïèse d’urgence dans la moelle osseuse.
Différents sous-ensembles de leucocytes ont répondu à différentes voies de signalisation déclenchées par A485. Il s’agit notamment des voies de la neutrophile dépendantes et indépendantes du G-CSF, mais également d’autres voies de la lymphocytose.
De plus, l’A485 utilise les voies neurohumorales, en particulier l’axe HPA, pour induire une leucocytose, comme en témoigne l’augmentation des taux sanguins de glucocorticoïdes après l’administration de l’A485. Cependant, la réponse de leucocytose déclenchée par l’activation de l’HPA n’est pas due aux glucocorticoïdes mais se produit en réponse à des signaux régulés par CRHR1, notamment l’hormone adrénocorticotrope (ACTH), qui se produit avec la perte des signaux de rétroaction HPA.
Alors que le nombre de neutrophiles augmente avec l’administration d’ACTH, le nombre de lymphocytes n’augmente qu’avec le blocage des glucocorticoïdes, ce qui suggère que les deux sont régulés différemment.
Quels sont les effets ?
“L’inhibition compétitive, réversible et médiée par de petites molécules du domaine CBP/p300 HAT déclenche une mobilisation aiguë et transitoire des leucocytes de la moelle osseuse« Des recherches supplémentaires sont nécessaires pour déterminer quels contextes cliniques sont idéaux pour ce médicament. L’A485 peut être meilleur si seule une augmentation rapide et à court terme des neutrophiles est requise, tandis que la récupération à long terme de la production de cellules sanguines dans la moelle osseuse peut nécessiter du G-. CSF.
Pour obtenir de bons résultats, le moment de l’administration doit également être déterminé, car les patients atteints de sepsis neutropénique se présentent à des moments et à des stades différents. De plus, la valeur de ces médicaments dans le traitement du sepsis bactérien ou viral plutôt que listérique reste inexplorée.
Cependant, comme l’ont rapporté des chercheurs précédents, il a un effet antitumoral, ce qui pourrait le rendre utile pour le traitement adjuvant des patients atteints de cancer. La présente étude met également en lumière le rôle de l’ACTH, plutôt que de ses dérivés, les glucocorticoïdes, dans l’homéostasie des leucocytes et l’activité du G-CSF.
