Une étude montre l’évolution de la protéine humaine du capteur de froid et de menthol
[ad_1]
La douleur chronique touche des millions de personnes dans le monde et les traitements actuels reposent souvent sur les opioïdes, qui comportent un risque de dépendance et de surdose.
Des alternatives non addictives pourraient révolutionner le traitement de la douleur, et de nouvelles recherches ciblant la protéine humaine qui régule les sensations de froid rapprochent les scientifiques du développement d’analgésiques qui n’affectent pas la température corporelle et ne présentent aucun risque de dépendance.
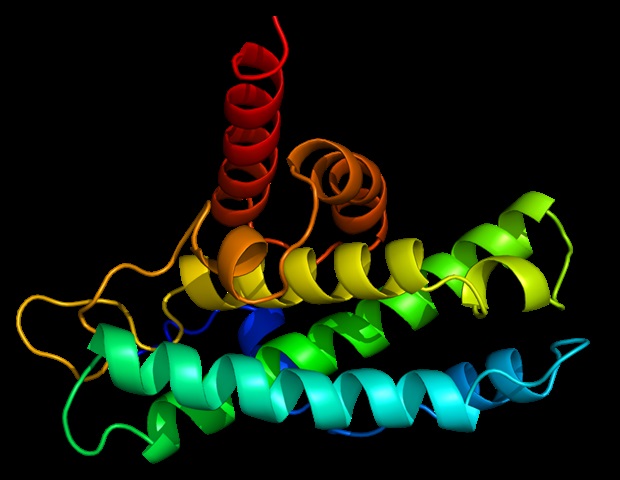
Recherche publiée dans Avancées scientifiques le 21 juin, dirigé par Wade Van Horn, professeur à l’École des sciences moléculaires et au Centre de bioconception pour les diagnostics personnalisés de l’Arizona State University, a acquis de nouvelles connaissances sur le capteur humain clé du rhume et du menthol TRPM8 (potentiel de récepteur transitoire mélastatine 8). Utilisant des techniques issues de nombreux domaines comme la biochimie et la biophysique, leur étude a révélé qu’il s’agissait d’un capteur chimique avant de devenir un capteur de température froide.
“Si nous commençons à comprendre comment découpler la perception chimique du froid de la perception réelle du froid, nous pourrions théoriquement créer des médicaments sans effets secondaires”, a déclaré Van Horn, dont les recherches portent sur les protéines membranaires impliquées dans la santé et la maladie humaines. sont. “En comprenant l’histoire évolutive du TRPM8, nous espérons contribuer au développement de meilleurs médicaments qui procurent un soulagement sans les effets secondaires dangereux associés aux analgésiques actuels.”
Lorsqu’une personne touche une table en métal et qu’elle a froid, le corps humain active TRPM8. Pour les patients atteints de cancer qui prennent certains médicaments de chimiothérapie, toucher un bureau peut être douloureux. TRPM8 est également impliqué dans de nombreux autres types de douleur, notamment les douleurs neuropathiques et inflammatoires chroniques.
En comprenant mieux cette spécificité de la perception chimique du froid par rapport à la perception physique du froid, les scientifiques peuvent obtenir un soulagement sans déclencher les effets secondaires de la régulation de la température souvent observés dans les essais cliniques TRPM8 pour le traitement de la douleur.
Dans la recherche, l’équipe a utilisé la reconstruction de séquences ancestrales, une sorte de machine à voyager dans le temps pour les protéines, a rassemblé l’arbre généalogique de TRPM8 qui existe aujourd’hui, puis a utilisé ces informations pour déterminer à quoi auraient pu ressembler les protéines d’animaux disparus depuis longtemps.
En utilisant des méthodes informatiques pour ressusciter le TRPM8 ancestral des primates, des mammifères et des vertébrés, les chercheurs ont pu comprendre comment TRPM8 a changé au fil des centaines de millions d’années en comparant les séquences de protéines actuelles pour prédire les séquences de leurs anciens ancêtres. De plus, la combinaison d’expériences en laboratoire et d’études informatiques permet aux chercheurs d’identifier les emplacements critiques dans TRPM8, offrant ainsi une compréhension plus claire de la mesure de la température qui peut être testée lors d’expériences ultérieures.
“L’analyse dynamique comparative du TRPM8 ancestral et humain soutient également les données expérimentales et nous permettra d’identifier les points critiques dans la mesure de la température, que nous testerons bientôt”, a déclaré Banu Ozkan, professeur au département de physique de l’ASU qui participe à l’étude. étude.
L’équipe a ensuite exprimé ces TRPM8 ancestraux dans des cellules humaines et les a caractérisés à l’aide de diverses techniques cellulaires et électrophysiologiques.
« Les études basées sur les protéines ancestrales nous permettent de nous concentrer sur la lignée qui nous intéresse le plus, comme : “Nous utilisons des médicaments d’origine humaine, tels que le TRPM8 humain, pour répondre aux problèmes de développement de médicaments dus à des différences de spéciation telles que celles chez la souris et chez l’homme”, a déclaré l’auteur principal de l’étude, Dustin Luu, étudiant diplômé à l’École des sciences moléculaires de l’ASU. et chercheur postdoctoral actuel au Biodesign Center for Personalized ASU Diagnostics.
Luu a poursuivi : « Nous avons découvert de manière surprenante que la perception du menthol apparaissait bien avant la perception du froid. La différence d’apparence et d’atténuation de ces modes d’activation suggère qu’ils sont distincts et peuvent être démêlés grâce à des recherches plus approfondies, permettant ainsi de nouvelles thérapies contre la douleur sans les effets secondaires indésirables de la détection de la chaleur.
Alors que la science continue de découvrir les secrets de nos mécanismes biologiques, des études comme celles-ci illustrent comment la biologie évolutionniste et la pharmacologie moderne peuvent travailler ensemble pour répondre aux besoins médicaux urgents et améliorer la qualité de vie des personnes souffrant de douleur chronique.
[ad_2]
Source
